
-
Тел: +70976539277
-
Email: kronos@gmail.com
-
Мы в:

Тел: +70976539277
Email: kronos@gmail.com
Мы в:
|
to | ||
|
4HNO3 |
= |
2H2O + 4NO2O + O2O. |
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Органическая химия.
В органической химии к реакциям разложения относятся: дегидратация, дегидрирование» крекинг, дегидрогалогенирование, а также реакции деполимеризации, когда из полимера образуется исходный мономер. Соответствующие уравнения реакций:
to
С2Н5ОН → C2H4 + Н2O
to
С6Н14 → С6Н6 + 4Н2
гексан бензол
C8H18 → C4H10 + C4H8
Октан бутан бутен
C2H5Br → C2H4+ НВг
бромэтан этилен
(-СН2 – СН = С - СН2 -)n → n СН2 = СН – С = СН2
\СНз \ СНз
природный каучук 2-метилбутадиен-1,3
Реакции замещения.
При реакциях замещения обычно простое вещество взаимодействует со сложным, образуя другое простое вещество и другое сложное:
А + ВС = АВ + С.
Неорганическая химия.
Эти реакции в подавляющем большинстве принадлежат к окислительно-восстановительным:
2Аl + Fe2O3 = 2Fе + Аl2О3
Zn + 2НСl = ZnСl2 + Н2
2КВr + Сl2 = 2КСl + Вr2
2КСlO3 + l2 = 2KlO3 + Сl2.
Примеры реакций замещения, не сопровождающихся изменением валентных состояний атомов, крайне немногочисленны. Следует отметить реакцию двуокиси кремния с солями кислородсодержащих кислот, которым отвечают газообразные или летучие ангидриды:
СаСО3+ SiO2 = СаSiO3 + СО2
Са3(РО4)2 + ЗSiO2 = ЗСаSiO3 + Р2О5
Органическая химия.
В органической химии реакции замещения понимаются шире, то есть замещать может не один атом, а группа атомов или замещается не атом, а группа атомов. К разновидности реакции замещения можно отнести нитрование и галогенирование предельных углеводородов, ароматических соединений и спиртов:
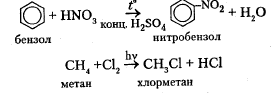
C6H6 + Br2 → C6H5Br + HBr
бензол бромбензол
C2H5OH + HCl → C2H5Cl + H2O
этанол хлорэтан
Реакции обмена.
Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями:
АВ + СD = АD + СВ.
Неорганическая химия
Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами - оксидами, основаниями, кислотами и солями:
ZnO + Н2SО4 = ZnSО4 + Н2О
AgNО3 + КВr = АgВr + КNО3
СrСl3 + ЗNаОН = Сr(ОН)3 + ЗNаСl.
Частный случай этих реакций обмена - реакции нейтрализации:
НСl + КОН = КСl + Н2О.
Обычно эти реакции подчиняются законам химического равновесия и протекают в том направлении, где хотя бы одно из веществ удаляется из сферы реакции в виде газообразного, летучего вещества, осадка или малодиссоциирующего (для растворов) соединения:
NаНСО3 + НСl = NаСl + Н2О + СО2↑
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О
Органическая химия
НСООН + NaOH → HCOONa + Н2O
муравьиная кислота формиат натрия
Происхождение и развитие галактик и звезд
К
началу нашего века границы разведанной Вселенной раздвинулись настолько, что
включили в себя Галактику. Многие, если не все, думали тогда, что эта огромная
звездная система и есть вся Вселенная в целом.
Но
вот в 20-е годы были построены новые крупные телескопы, и перед астрономами
открылись совершенно неожиданные ...
Расчет и проектирование внутреннего водопровода
В
городах и на промышленных предприятиях расходуют большое количество воды. Ее
используют на хозяйственно-питьевые и производственные нужды, а также для
пожаротушения. Обеспечение населения водой питьевого качества повышает уровень
благоустройства городов, улучшает их санитарное состояние и предохраняет людей
от эпидем ...