
-
Тел: +70976539277
-
Email: kronos@gmail.com
-
Мы в:

Тел: +70976539277
Email: kronos@gmail.com
Мы в:
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
|
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I - III групп образуют твердые вещества - гидриды (водород в степени окисления - 1), а IV - VII групп - газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) - нейтральны, V группы (ЭН3) - основания, VI и VII групп (Н2Э и НЭ) - кислоты.
От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус - по периоду слева направо уменьшается, а в подгруппе сверху вниз возрастает; энергия ионизации - по периоду возрастает, а в подгруппе уменьшается; электроотрицательность - по периоду увеличивается, а в подгруппе уменьшается.
По положению элемента в периодической системе можно прогнозировать его основные свойства как средние всех его соседей:
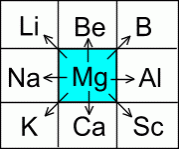
Пример:
На основании периодической таблицы охарактеризуйте химический элемент с порядковым номером 21.
Для характеристики химического элемента по периодической системе Д.И.Менделеева следует рассмотреть:
1. Положение в периодической таблице (порядковый номер; период, ряд; группа, подгруппа; атомная масса).
2. Строение атома (заряд ядра; состав ядра - количество протонов p11, нейтронов n01 и электронов e; число энергетических уровней и подуровней; написать формулу электронной конфигурации; квантовые ячейки; по числу и характеру валентных электронов определить тип элемента).
Международные космические организации
Тема
моей работы Международные космические организации. Целью данной работы является
дать общую характеристику комических организаций, раскрыть принципы
деятельности международных космических организаций показать актуальность данной
темы, показать организационную структуру, задачи, вопросы членства в
международных орга ...
O Л. В. Канторовиче и линейном программировании
Я
хочу написать о том, что я помню и знаю о деятельности Леонида Витальевича
Канторовича, выдающегося ученого ХХ века, о его борьбе за признание своих экономико-математических
теорий, о начальном этапе истории линейного программирования, о зарождении
новой области математической деятельности, связанной с экономическими
...