
-
Тел: +70976539277
-
Email: kronos@gmail.com
-
Мы в:

Тел: +70976539277
Email: kronos@gmail.com
Мы в:
Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.
Энергетическая диаграмма химической реакции.
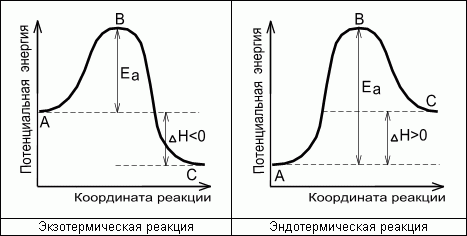
А - реагенты, В - активированный комплекс (переходное состояние), С - продукты.
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
4. Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
5. Катализ. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").
Химическое равновесие.
Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях.
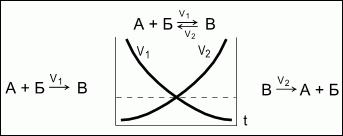
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB <-> pC + dD константа равновесия равна
K = K1 / K2 = ([C]p • [D]d) / ([A]m • [B]n)
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции.
Способы смещения равновесия.
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
|
V1 | ||
|
A + Б |
<-> |
В |
|
V2 |
1. Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
|
V1 | |||
|
A + Б |
<-> |
В |
; увеличение P приводит к V1 > V2 |
|
V2 | |||
|
2 |
1 |
Структурные уровни организации материи
Развитие
- это необратимое, направленное, закономерное изменение материи и сознания, их
универсальное свойство; в результате развития возникает новое качественное
состояние объекта - его состава или структуры. Развитие - всеобщий принцип
объяснения природы, общества и познания, как исторически протекающих событий.
Р ...
Возможности использования анализатора жидкости Флюорат 02-3м для анализа питьевой и природной воды
Государственное
унитарное предприятие "Центр исследования и контроля воды",
осуществляющее регулярный контроль питьевых и сточных вод предприятий
Санкт-Петербурга, имеет многолетний опыт разработки методик выполнения
измерений и испытания средств измерения. В последние годы Центр исследования и
контроля воды ...