
-
Тел: +70976539277
-
Email: kronos@gmail.com
-
Мы в:

Тел: +70976539277
Email: kronos@gmail.com
Мы в:
С – химический элемент IV группы периодической системы Менделеева, атомный номер 6, относительная атомная масса 12, 011(1).
Многообразие соединений углерода, объясняющееся способностью его атомов соединяться друг с другом и атомами других элементов различными способами, обусловливает особое положение углерода среди других элементов.
Аллотропные видоизменения углерода.
Элементарный углерод образует три аллотропных видоизменения: алмаз, графит и карбин.
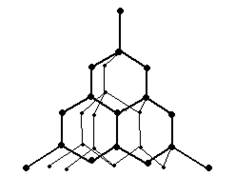 Алмаз – бесцветное, прозрачное кристаллическое вещество, чрезвычайно сильно преломляющее лучи света. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации. В возбужденном состоянии происходит распаривание валентных электронов в атомах углерода и образование четырех не спаренных электронов.
Алмаз – бесцветное, прозрачное кристаллическое вещество, чрезвычайно сильно преломляющее лучи света. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации. В возбужденном состоянии происходит распаривание валентных электронов в атомах углерода и образование четырех не спаренных электронов.
![]()
![]() Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от него в направлении от центра в тетраэдров к вершинам. Расстояние между атомами в тетраэдрах равно 0, 154 нм. Прочность всех связей одинакова. Таким образом, атомы в алмазе «упакованы» очень плотно. При 20оС плотность алмаза составляет 3,1515 г/см3 . Этим объясняется его исключительная твердость. Алмаз плохо проводит электрический ток. Основная масса , образования алмазов – небольшие кристаллы и алмазная пыль.
Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от него в направлении от центра в тетраэдров к вершинам. Расстояние между атомами в тетраэдрах равно 0, 154 нм. Прочность всех связей одинакова. Таким образом, атомы в алмазе «упакованы» очень плотно. При 20оС плотность алмаза составляет 3,1515 г/см3 . Этим объясняется его исключительная твердость. Алмаз плохо проводит электрический ток. Основная масса , образования алмазов – небольшие кристаллы и алмазная пыль.
Алмазы при нагревании без доступа воздуха выше 1000оС превращается в графит. При 1750оС превращение алмаза в графит происходит быстро.
Графит – серо-черное кристаллическое вещество с металлическим блеском, жирное на ощупь, по твердости уступает даже бумаге.
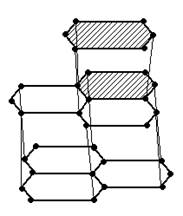 Атомы углерода в кристаллах графита находятся в состоянии sp2 – гибридизации: каждый из них образует трех ковалентные ơ-связис соседними атомами. Углы между направлениями связей равна 120о. В результате образуется сетка, состоящая из правильных шестиугольников. Расстояние между соседними ядрами атомов углерода внутри слоя составляет 0,142нм.
Атомы углерода в кристаллах графита находятся в состоянии sp2 – гибридизации: каждый из них образует трех ковалентные ơ-связис соседними атомами. Углы между направлениями связей равна 120о. В результате образуется сетка, состоящая из правильных шестиугольников. Расстояние между соседними ядрами атомов углерода внутри слоя составляет 0,142нм.
Графит имеет низкую механическую прочность и легко расщепляется на чешуйки, которые сами по себе очень прочны. Связь между слоями атомов углерода в графите частично имеет металлический характер. Этим объясняется тот факт, что графит хорошо проводит электрический ток, но все же не так, как металл.
![]() При нагревании без доступа воздуха графит не претерпевает никакого изменения до 3700оС. При указанной температуре он выгоняется, не плавясь. Графит термодинамичен, устойчив в широком интервале температур и давлений. Плотность составляет 2,256 г/см3.
При нагревании без доступа воздуха графит не претерпевает никакого изменения до 3700оС. При указанной температуре он выгоняется, не плавясь. Графит термодинамичен, устойчив в широком интервале температур и давлений. Плотность составляет 2,256 г/см3.
Применение.
Алмазы используются для обработки различных твердых материалов, для резки, шлифования, сверления и гравировки стекла, для бурения горных пород. Алмазы после шлифовки и огранки превращаются в бриллианты, которые используются как украшения.
Из графита изготовляют литейные формы, плавильные тигли, огнеупорные изделия. Значимое количества графита используется в электротехнической промышленности, например, при изготовлении электродов. Графит используется для изготовления карандашей, красок. Чистый графит используется в ядерных реакторах для замедления нейронов.
Начала кондуктометрии
Кондуктометрия
занимается изучением электропроводности растворов. В этой области электрохимии
принято оперировать 2-мя характерными величинами: удельной электропроводностью
(k - каппа) и эквивалентной электропроводностью (l ). Поясним физический смысл
этих величин.
Удельной
электропроводностью называется электропро ...
Астероиды вблизи Земли
Возможно,
нам, жителям Земли, наиболее важно знать астероиды, орбиты которых близко
подходят к орбите нашей планеты. Обычно выделяют три семейства сближающихся с
Землёй астероидов. Они названы по именам типичных представителей - малых
планет: 1221 Амур, 1862 Аполлон, 2962 Атон. К семейству Амура относятся
астероиды, ор ...